目前医药研究中心现有两款流式细胞仪,Beckmancoulter EPICS-XL购自2001年,目前主要检测DNA倍体分析、细胞凋亡等实验中用到PI染料的样本。BD FACSAria III是近年新添置的分选机型,可以进行多色样本分析和细胞分选。

贝克曼库尔特的EPICS-XL(分析机)

BD的BD FACSAria III(分选机)
流式细胞仪的应用
流式细胞仪的细胞学应用:
细胞结构
= 细胞大小
= 细胞粒度
= 细胞表面面积
= 核浆比例
= DNA含量与细胞周期
= RNA含量
= 蛋白质含量
= 染色体分析
细胞功能
= 细胞表面/胞浆/核的特异性抗原
= 细胞活性
= 细胞内细胞因子
= 酶活性
= 激素结合位点
= 细胞受体
= 细胞凋亡
流式细胞仪的科研应用:
= 免疫功能研究
= 癌症病人的多药耐药性
= 细胞动力学功能研究
= 动物性别筛选
= 海洋与环境微生物分析
= 染色体分选
流式细胞仪的临床应用:
= HIV免疫分型,CD4绝对计数
= 白血病和淋巴瘤的免疫分型
= 肿瘤的细胞周期和倍体分析
= 网织红细胞计数
= 细胞移植的交叉配型和免疫状态监测
= 干细胞计数
= 残量白血病细胞检查
= HLA-B27检查
= 血小板功能及相关疾病
凡是能被荧光素标记的细胞或颗粒都可用流式细胞仪检测。
前提这种荧光素能被流式细胞仪所配置的激光光源激发。
样本的制作
流式细胞仪的研究对象为生物颗粒,如各种细胞、染色体、微生物、及人工合成微球等。
流式细胞仪样本上样前要进行单细胞悬液制备。
细胞悬液:
细胞:
分离PBMC、PRP
直接使用外周血、骨髓、灌洗液、体腔积液
培养细胞、细胞系
实体组织:
病理组织:新鲜样本/石蜡包埋样本,石蜡包埋样本不建议进行细胞分选。
针吸组织:新鲜样本
鞘液、洗液等:清洁无颗粒杂质
一般的流式样本为:生物颗粒+荧光素
如下图:

对照管的设置
阴性对照的设置-去除非特异性荧光;FMO对照-精确界定不同亚群在某一通道的阴阳界限;阳性对照-检测偶联抗体是否有效。
1、阴性对照的设计:
以“CD69-PE”为例
Negative:不加任何荧光素抗体时得到的荧光信号。-最简单也最常用。
“抗CD69”:用抗CD69标记样品细胞后得到的荧光信号。-一般不会使用。
同型对照-IgG1-PE:与抗CD69标记抗体同种属(来源于同一物种)且同类(抗CD69抗体是IgG1类)的非特异性抗体与PE荧光素偶联的同型对照结合后得到的荧光信号。-在此基础上得出的流式结果是最可靠的。
每次流式分析都必须设置阴性对照。细胞的非特异性荧光的强弱由细胞本身所决定,与细胞的体积大小有关,一般细胞体积越大,其非特异性荧光越强,体积越小,非特异性荧光越弱。
2、FMO对照:
是一种特殊的阴性对照,是指在多色(通道)分析时对其中某一个通道特别设置的阴性对照,对在研究不同细胞亚群表达某些重要的表型分子、细胞因子等时使用。
以检测人PBMC中的CD62L+CD4+和CD62L-CD4+两个细胞亚群中表达CD45RA这个重要表型分子为例:
检测时样本需同时标记不同荧光素偶联抗的抗人CD4、CD62L和CD45RA抗体,除了设置阴性对照外,最好设置一组FMO对照,即只标记荧光素偶联抗人CD4和CD62L抗体,而不标记荧光素偶联CD45RA抗体,然后将CD62L+CD4+和CD62L-CD4+两个细胞亚群分别设门,将两群细胞分别显示于新的散点图中,散点图上其中以个轴代表CD45RA的荧光信号,这时就可以分别设置这两个细胞亚群CD45RA通道的阴阳界限,然后上样实验组,根据不同细胞亚群各自的阴阳界限分别判定细胞亚群各自表达CD45RA的情况。
3、阳性对照:
在使用某种荧光素偶联抗体前先采用一定的方法检测该荧光素偶联抗体是否失效。
阳性对照的检测方法:
用肯定表达有相应抗原分子的样品细胞来检测。
将已经证明能有效地与待测荧光素抗体的单克隆抗体相同但偶联的荧光素不同的荧光素偶联抗体与待测抗体同时标记一份肯定表达的样品细胞。
阳性对照不是每次进行流式分析时都必须设置的,一般在遇到以下情况时设置:使用新的荧光素偶联抗体时,该荧光素偶联抗体以前没有使用过;使用不同公司的或者同一公司但不同批号的荧光素偶联抗体时;使用储存时间较长的荧光素偶联抗体时。
补偿管的设置
设置补偿管的原因:
流式荧光素在相应的激光激发后发射的荧光波长并不是完全集中于一个很小的范围。

以FITC荧光素为例,在其检测通道(FL1)范围内约80%,约有10%落在FL2通道内,另外10%既不被FL1接收也不被FL2接收。PE荧光素有85%集中在FL2接收通道,5%被FL1接收另外的10%既不被FL1接收也不被FL2接收。
在同一样本同时标记了这两种荧光素偶联抗体时,FL1通道接收的为荧光信号来源即无法确定,有可能来源于FITC,有可能来源于PE,也有可能是两种荧光信号的混合组成。为了让FL1通道代表FL1荧光信号,FL2代表PE荧光信号,流式细胞术用补偿调节来实现。
排除FL2中来自于FITC的荧光信号,就设置“FL2-FL1”(“PE-FITC”)的补偿值,使FL2完全代表PE的荧光信号。排除FL1中来自于PE的荧光信号,就设置“FL1-FL2”(“ FITC -PE”)的补偿值,使FL1完全代表FITC的荧光信号。
补偿管的设置:
以同时标记FITC-CD4,PE-CD8抗体为例:
需要的准备的样本:
阴性对照管(IgG1-TITC, IgG2-PE)
FITC补偿管(FITC-CD4, IgG2-PE)
PE补偿管(IgG1-TITC, PE-CD8)
样本管(FITC-CD4,PE-CD8)
单色分析不需要做补偿。
三色和四色分析的补偿,两两补偿。
荧光素的选择
在开始实验前,请先看一下我们的仪器能否检测你需要购买的荧光素试剂。
如果您所使用的荧光素的激发波长与我们仪器的激发器相差太大是无法进行检测的。
如果您所使用的荧光素的发射波长不在仪器的检测通道之内也是无法进行检测的。
Beckmancoulter EPICS-XL

BD FACSAria III

上机检测
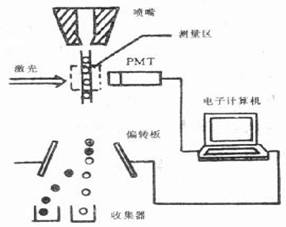
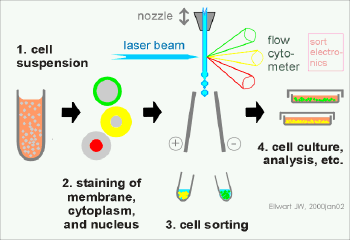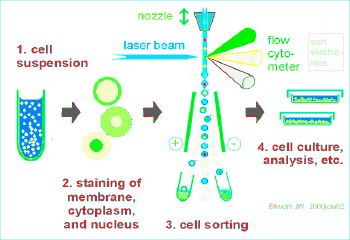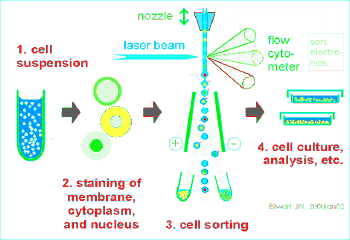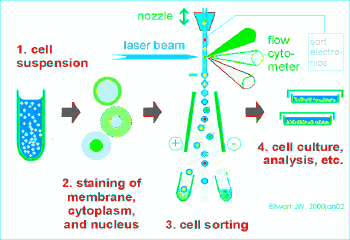
流式细胞仪的基本结构:
流动室和液流系统;激光源和光学系统;光电管和检测系统;计算机和分析系统。
流式细胞仪的工作原理:
待测细胞以单个细胞的悬液,经特异性荧光染料染色,放入样品管,吸入流动室。流动室充满鞘液,作用:约束样品在喷嘴中心,防止样品靠近喷孔壁堵塞喷孔。细胞排成单列由喷嘴中心喷出,形成细胞液柱。
液柱与激光束相交,细胞上的荧光染料被激发产生荧光。
荧光信号变成电信号输出到计算机,软件分析。
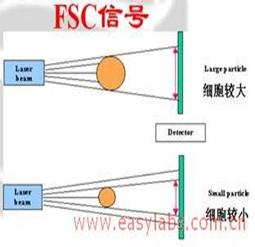
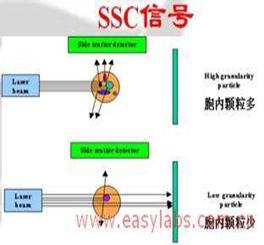
流式细胞仪可检测到的细胞参数
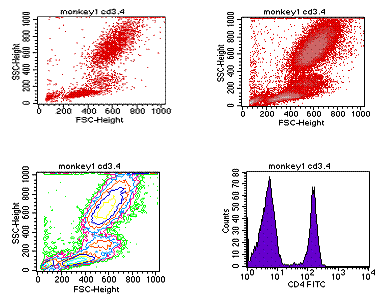
前向角散射光(FSC)-细胞相对大小及其表面积 。
侧向角散射光(SSC)-细胞颗粒度及细胞内细胞器的相对复杂性。

荧光信号:
荧光强度(FL):细胞上的荧光染料被激光激发后发射出的荧光,不同的荧光染料其发射波长不同。
有荧光标记的细胞与无荧光标记的区分开来(阴阳)
高FL细胞与低FL细胞区分开来(强弱)
细胞分选:
流式分选就是先对样品细胞进行流式分析,判断该细胞是否为目标细胞,如果是目标细胞,则对该细胞施加一定电量的正或负电荷,目标细胞在强电场中发生偏转进入接收管中;如果不是目标细胞,则对该细胞不做处理,细胞不带电荷,在强电场中不发生偏转而直接进入废液孔中。
流式结果分析
流式报告的图一般分为四种,即散点图、直方图、密度图和二维等高图等。最常用的为散点图和直方图。
相关概念:
%Gated:阳性细胞百分比。反映细胞群体中阳性细胞的数量。
Mean:平均荧光强度,与被检测物质的表达量有关,在正态分布时一般用该值。
Geo Mean:几何平均荧光强度,在阳性细胞为偏态分布时一般用该值。
注意事项
1. 预约时间
Beckmancoulter EPICS-XL分析型流式仪提前一天预约,BD FACSAria III分选—提前一周预约;
预约时告知姓名、实验内容、使用时间、荧光染料类别(我们这XL只有488激光,BD的仪器有488和633两个激光器);
如果因特殊原因需要推迟实验请及时通知,以便调整开机检测时间。
2. 样本量
样本管内液体量最好在500ul-1000ul,样本内细胞量在5´105-5´106。
3. 做完实验后请及时清理实验所产生的垃圾。
4. 数据拷贝
实验完成后请及时拷走数据,实验室将定时清理数据。
Beckmancoulter EPICS-XL不能使用刻录光盘,统一使用我们提供的U盘,用前格式化。
5、 荧光素的选择。
不要重复使用发射波长范围相近的荧光素,如GFP与FITC,一般来说,同厂家的机器与试剂相匹配的检测的结果最优。

